2021 年碩士研究生入學考試物理化學考試大綱
一、考試范圍及要點
1、化學熱力學
(1) 熱力學第一定律及熱力學第二定律
了解熱力學基本術語:平衡狀態(tài),狀態(tài)函數(shù),可逆過程,熱力學標準態(tài)。熟練掌握熱力學第一、第二、第三定律的敘述及數(shù)學表達式。理解熱力學能、焓、熵、Helmholtz 函數(shù)和 Gibbs 函數(shù)等熱力學函數(shù)以及標準燃燒焓、標準生成焓、標準摩爾熵和標準生成 Gibbs 函數(shù)等概念。掌握在物質的 p,V,T 變化、相變化和化學變化過程中計算熱、功和各種過程狀態(tài)函數(shù)變化值的原理和方法。在熱力學一般關系式應用于特定系統(tǒng)的時候,會應用狀態(tài)方程(主要是理想氣體狀態(tài)方程,其次是 van der Waal 方程)和物性數(shù)據(jù)(熱容、相變熱、蒸汽壓等)。熟練掌握熵增原理和各種平衡判據(jù)。明確熱力學公式適用條件。掌握熱力學基本方程和 Maxwell 關系式。了解用熱力學基本方程和 axwell 關系式推導重要熱力學公式的演繹方法。
(2) 多組分系統(tǒng)熱力學
理解偏摩爾量和化學勢的概念;了解 Clapeyron 和 Clausius-Clapeyron 方程,并能應用這些方程進行相關計算。掌握 Raoult 定律和 Henry 定律以及它們的應用;了解理想液態(tài)混合物和稀溶液中各組分化學勢的表達式;掌握稀溶液的依數(shù)性質;理解逸度和活度的概念,了解逸度和活度的標準態(tài)和對組分逸度系數(shù)和活度系數(shù)的簡單計算方法。
(3) 相平衡
理解相律的推導和意義;熟練掌握單組分體系、二組分體系和三組分體系典型相圖的特點和應用,能用杠桿規(guī)則進行計算,能用相律進行相圖分析。
(4)化學平衡
掌握熱力學標準平衡常數(shù)的定義;了解化學平衡等溫方程的推導,掌握用等溫方程判斷化學反應的方向和限度的方法;會用熱力學數(shù)據(jù)計算標準平衡常數(shù);理解溫度對平衡常數(shù)的影響,會用等壓方程計算不同溫度下的標準平衡常數(shù);了解系統(tǒng)壓力和惰性氣體對化學反應平衡組成的影響。
2、電化學基礎
了解電解質溶液的導電機理、離子遷移數(shù)及表征電解質溶液的導電能力的物理量(電導、電導率、摩爾電導率等);理解電解質溶液活度、離子平均活度及離子平均活度系數(shù)的概念;了解離子強度的概念和 Debye-Hüeckel 極限公式。熟練掌握可逆電池電動勢與熱力學函數(shù)的關系;掌握 Nernst 方程及其計算;了解各種類型電極的特征和電動勢測定的主要應用。理解產生電極極化的原因和超電勢的概念;了解化學腐蝕和電化學腐蝕的基本原理和防止腐蝕的方法。
3、表面物理化學
理解比表面 Gibss 能和表面張力的概念;了解彎曲界面的附加壓力概念和 Laplace公式及其應用;掌握 Kelvin 公式及其應用。了解潤濕、接觸角、鋪展毛細現(xiàn)象等基本術語,掌握 Young 方程;了解溶液界面的吸附及表面活性物質的作用及其應用,理解 Gibss 吸附等溫式;了解物理吸附與化學吸附的含義和區(qū)別,理解Langmuir 單分子層吸附模型和吸附等溫式。了解多分子層吸附和 BET 方程。
4、化學動力學基礎
了解化學反應速率、速率常數(shù)、基元反應、反應分子數(shù)及反應級數(shù)等概念,掌握通過實驗建立速率方程的方法;掌握簡單級數(shù)反應的速率方程及特征;理解對峙反應、平行反應和連串反應的動力學特征及在化學反應中的應用。掌握由反應機理建立速率方程的近似方法(穩(wěn)定態(tài)近似法、平衡態(tài)近似法);了解鏈反應、催化反應、光化學反應和溶液中反應的動力學基本特征。掌握 Arrhennius 方程及應用,了解活化能和指前因子的物理意義;了解碰撞理論、過渡狀態(tài)理論的基本思想、基本公式及有關概念。
5、膠體化學
了解膠體的制備方法。掌握膠體的若干重要性質(動力性質、電學性質、光學性質)。理解膠團的結構和擴散雙電層概念。熟練掌握溶膠的穩(wěn)定性和聚沉作用,了解影響聚沉作用的重要因素。了解乳狀液和凝膠的概念。
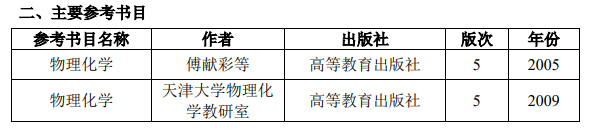
原文標題:2021年攻讀碩士學位研究生招生專業(yè)目錄
原文鏈接:http://www.grinm.com/617-1003-16589.aspx
以上就是“2021考研大綱:北京有色金屬研究院物理化學2021年碩士研究生考試大綱及參考書目”的全部內容,更多考研大綱信息,請多多關注!




